5.6.3. Пиролиз древесиныКотлы / Дачные бани и печи. Принципы конструирования / 5. Климатический (отопительный) модуль / 5.6.3. Пиролиз древесиныСтраница 2
Процессы пиролиза, как правило, завершаются при нагреве древесины до 500-600°С. Но если продукты пиролиза заключить в герметичную ёмкость (бомбу) и нагреть их до более высоких температур, то состав продуктов пиролиза изменится. Этот факт очень важен для анализа процессов горения, поэтому вкратце остановимся на основных особенностях вторичного пиролиза. Во-первых, жидкие и газообразные продукты первичного пиролиза разрушаются до простейших соединений (Н20,С02, СО, Н2 и т. п.) и добавочного количества углерода как в форме древесного угля, так и в виде сажи (в том числе и в виде дыма). При этом даже метан образует сажу именно через бензольные кольца. Во-вторых, древесный уголь (углерод) начинает газифицироваться - реагировать с водяными парами С+Н2О ±+ СО+Н2. Количество воды в продуктах пиролиза очень велико, что видно хотя бы из того, что балансовую химическую формулу целлюлозы и гемицеллюлозы (СбНюОб) можно представить в виде [Сб(Н20)5]п, то есть комбинации (смеси) углерода и воды (поэтому целлюлозу называют углеводом). Приведём расчётный состав продуктов реакции газификации углерода в синтез-газ С+Н2О -+СО+Н2 в условиях атмосферного давления газовой фазы ро=р(Н20)+ +р(СО)+р(Н2)=1 атм, где р(Н20), р(СО) и р(Н2) - парциальные давления водяных паров, окиси углерода (угарного газа) и водорода соответственно (Н.В. Лавров, А.П. Шурыгин, Введение в теорию горения и газификации топлива, М.: АН СССР, 1962 г.):
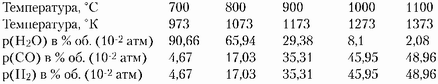
Приведённые численные данные могут быть легко перечитаны на другие давления газовой среды ро, исходя из соотношений равновесия р(С)-р(Н20)=К1(Т)-р(СО)-р(Н20), где р(С) - давление паров углерода (зависит только от температуры), К1(Т) - коэффициент равновесия реакции (зависит только от температуры), р(СО)=р(Н20). При этом можно показать, что р(Н2О)/р(СО)=А1(г1(Т)р0)1/2, где Г1(Т)=К1(Т)/р(С), А1 - коэффициент пропорциональности. Таким образом, снижение давления ро (то есть уменьшение количества воды) приводит к сдвигу реакции вправо (то есть к более высокому преобразованию Н2О в СО).
В-третьих, древесный уголь (углерод) начинает газифицироваться в ходе реакции С+СО2 ^ 2СО. Приведём расчётный состав продуктов реакции при давлении газовой среды ро=р(С02)+(СО)=1 атм:

Пересчёт на другие давления ведётся по соотношениям р(С)р(С02)= =К2(Т)р2(СО), г2(Т)=К2(Т)/р(С). При этом р(С02)/р(СО)= =А2^2(Т)ро)1Л то есть снижение давления ро сдвигает реакцию вправо. В целом, реакция углерода с СО2 (углекислым газом) начинается примерно при температурах на 100°С выше, чем реакция с Н2О (водой), а учитывая, что воды в продуктах пиролиза намного больше, чем углекислого газа, то реакция газификации водой является ведущей.
Продукты высокотемпературного «вторичного» пиролиза, состоящие преимущественно из СО и Н2, называются синтез-газом или газогенераторными газами. Такие газы вырабатывались в первой половине XX века в огромных масштабах для лесохимических производств, отопления, а также для использования в качестве топлива в двигателях внутреннего сгорания. До сих пор часто вспоминают довоенные советские грузовики-полуторки с бортовыми газогенераторами, вырабатывавшими для своего двигателя горючий синтез-газ из древесных чурок длиной сантиметров десять, которые по государственному план-заказу (разнарядке) заготавливались колхозами в огромных количествах.
Характер термического разрушения древесины при температурах ниже 300-350°С практически не зависит от того, в инертной среде или воздушной ведётся нагрев древесины. При более высоких температурах уже возможны процессы дополнительного окисления свободным кислородом СпНтОк +О2 ® СО2+Н2О, в том числе аморфного углерода по реакции С+О2 ® СО2. Пиролиз называется окислительным в том случае, когда количество вводимого кислорода настолько мало, что теплота окисления остаётся намного меньшей, чем подвод тепла для пиролиза извне. Если же количество подводимого кислорода уже начинает обеспечивать большую величину теплового эффекта окисления, то окислительный пиролиз приобретает название горения.
В заключение напомним, что сухая безводная окись углерода СО (угарный газ) практически не реагирует с кислородом О2 до температуры 700°С. Выше 700°С протекает медленная гетерогенная реакция, то есть реакция идёт не в объёме, а с первоначальной сорбцией СО на поверхности твёрдых материалов. Причём некоторые вещества способны существенно снизить температуру окисленияСО (например, в составе катализаторов для очистки выхлопных газов автомобилей от угарного газа). На скорость окисления углерода сильно влияет присутствие даже небольших количеств водяного пара или водорода, при этом реакция может стать даже гомогенной (в объёме) вне поверхностей твёрдых мате